德思特生物專注于中藥(植物藥)物質(zhì)基礎(chǔ)研究以及天然化合物、中藥化學對照品實物生產(chǎn)供應(yīng)
您值得信賴的中藥成分及標準合作伙伴 滿足您研發(fā)和工業(yè)化需求
產(chǎn)品關(guān)鍵詞: 香草酸-4-β-D-葡萄糖苷 6-甲氧基山奈酚 茯苓新酸B 去甲異波爾定
028-8500-3950
| 公司傳真: | 028-85589956 |
| 公司郵箱: | sales@tcmlmt.com |
| 公司網(wǎng)址: | usemark.cn |
| 公司地址: | 四川省成都市溫江區(qū)海科路西段128號5棟 |
上一篇:蟾酥對照品成分檢測方法
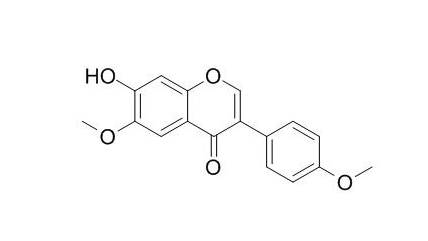
產(chǎn)品編碼:DA0040產(chǎn)品名稱:Afrormosine英文名:AfrormosineCAS登錄...
查看更多